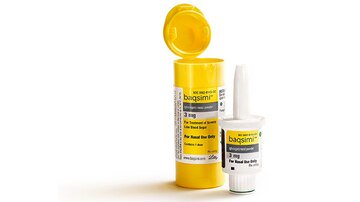
A Food and Drug Administration dos EUA (FDA) aprovou o primeiro produto de glucagon administrado por via nasal ( Baqsimi , Eli Lilly and Co) para o tratamento de hipoglicemia grave em pacientes com 4 anos ou mais que têm diabetes.
O pó nasal é o primeiro produto licenciado de glucagon que não é fornecido por injeção e que não requer um processo de mistura de várias etapas.
“Esse novo modo de administrar o glucagon pode simplificar o processo, que pode ser crítico durante um episódio de hipoglicemia, especialmente porque o paciente pode ter perdido a consciência ou estar tendo convulsões. Nessas situações, queremos que o processo trate a pessoa doente é o mais simples possível “, disse Janet Woodcock, MD, diretor do Centro de Avaliação e Pesquisa de Drogas da FDA, em um comunicado.
Lilly disse em um comunicado de imprensa : “Baqsimi é o primeiro e único glucagon administrado nasalmente , e foi projetado com resgate grave hipoglicemia em mente. É compacto, portátil e pronto para uso (sem necessidade de reconstituição) em um único, fixo, 3 dose mg “.
A empresa disse que planeja comercializar o novo agente pelo mesmo preço da atual injeção de glucagon. O preço de tabela dos EUA para um Baqsimi é de $ 280,80 para um pacote e de $ 561,60 para um pacote com dois. A empresa disse que está “em discussões com provedores de seguros para disponibilizar o Baqsimi para o maior número de pessoas possível”.
“Pessoas seguradas comercialmente elegíveis com diabetes podem pagar apenas US $ 25 por até dois dispositivos Baqsimi (1 pacote de dois ou 2 pacotes de um pacote) se usarem o cartão de poupança Lilly. Essa receita é geralmente preenchida anualmente, ” observou a empresa .
“A Lilly também poderá ajudar as pessoas que não têm cobertura de seguro comercial com opções encontradas no Lilly Diabetes Solutions Center quando Baqsimi estiver disponível nas farmácias dos Estados Unidos”, que deve estar em cerca de um mês, disse a empresa.
Produto deve ser muito mais fácil de usar do que injeção
A aprovação foi baseada em dados de três estudos de pessoas com diabetes tipo 1 . Um estudo envolveu 70 adultos, um envolveu 83 adultos e outro envolveu 48 crianças com 4 anos de idade ou mais.
A formulação nasal geralmente funcionou bem como injetou glucagon na reversão da hipoglicemia induzida por insulina, sem maiores problemas de segurança.
O novo produto, que vem em um dispensador de uso único, é vantajoso porque não requer injeção do conteúdo da seringa em um frasco, mistura e retirada da solução para dentro da seringa antes de injetar no paciente, um processo que pode ser intimidante e pode levar a erros quando realizados por pessoas não médicas em situações de emergência.
Segundo a FDA, o glucagon nasal não deve ser administrado a pessoas com feocromocitoma ou insulinoma. Devido ao mecanismo de ação do fármaco – estimula a liberação de glicose do fígado – o rótulo terá um aviso sobre o uso em indivíduos com capacidade diminuída de liberação de glicose hepática, incluindo aqueles que estão em jejum por longos períodos, têm insuficiência adrenal ou tem hipoglicemia crônica.
As reações adversas mais comuns associadas ao glucagon nasal são semelhantes às do glucagon injetado e incluem náuseas, vômitos e cefaléia . Por causa do modo nasal de administração, também pode causar olhos lacrimejantes e congestão nasal.
Fonte: Medscape- Diabetes e Endocrinologia – Por: Miriam E. Tucker , 25 de julho de 2019